Insulinooporność (z mojego doświadczenia gabinetowego) jest najczęściej diagnozowanym zaburzeniem metabolicznym. Również z tego powodu zajęłam się tym tematem na blogu. Z poprzednich wpisów wiesz, jakie objawy mogą wskazywać na insulinooporność, gdzie szukać pomocy, do lekarza jakiej specjalizacji się wybrać i jak przygotować się do badań diagnostycznych. Jeśli jesteś już na etapie leczenia farmakologicznego, to nim przeczytasz poniższy wpis o suplementacji wspierającej, najpierw zapoznaj się ze wskazówkami dotyczącymi żywienia. Podstawą leczenia insulinooporności jest zmiana nawyków żywieniowych, a nie medykamenty. Zarówno leki, jak i celowana suplementacja nie zastąpią właściwego odżywiania. Nie idź na skróty! Niemniej dopasowanie wszystkich puzzli układanki według mnie daje najlepsze efekty.
Metformina a berberyna, na co postawić?
Jak we wstępie wspominałam, leczenie insulinooporności przede wszystkim powinno opierać się na zmianie sposobu odżywiania (więcej o tym tutaj) i włączeniu aktywności fizycznej. Niestety, czasem to nie wystarcza i organizm potrzebuje wsparcia farmakologicznego. Lekiem najczęściej przepisywanym przez diabetologów pacjentom z insulinoopornością (ale także z cukrzycą typu 2) jest metformina. Farmaceutyk ma właściwości obniżające stężenie glukozy we krwi poprzez zmniejszenie wytwarzania glukozy w wątrobie i nasilenie działania insuliny w mięśniach i tkance tłuszczowej. Dodatkowo wykazuje też niewielki korzystny wpływ na stężenie lipidów w surowicy, zmniejszając poziom triglicerydów, cholesterolu całkowitego, LDL i VLDL. Niestety, spora grupa pacjentów po wprowadzeniu leku miewa problemy żołądkowo-jelitowe. Pojawiają się mdłości, bóle brzucha, luźne stolce, co bywa szczególnie uciążliwe rano. Znam wiele osób, które wskutek opisanych skutków ubocznych przerywało farmakoterapię. I tu pojawia się alternatywa dla metforminy, czyli berberyna. Związek ten znany jest od tysięcy lat i był wykorzystywany w tradycyjnej medycynie chińskiej, właśnie między innymi jako substancja przeciwcukrzycowa i regulująca gospodarkę węglowodanową. Obecnie, dobrych publikacji naukowych na temat berberyny mamy coraz więcej i faktycznie przypisuje jej się podobne działanie co metforminie.
W metaanalizie obejmującej 14 badań z randomizacją (w sumie ponad 1060 osób) wykazano, że podawanie berberyny w dawce dobowej od 500 do 1500 mg korzystnie wpłynęło na metabolizm glukozy. Zaobserwowano obniżenie stężenia glukozy na czczo i poposiłkowej, hemoglobiny glikowanej, a także insuliny na czczo i poziomu trójglicerydów.
Co istotne, berberyna jest uznawana za substancję bezpieczną, a jej przyjmowanie nie wiąże się ze skutkami ubocznymi charakterystycznymi dla metforminy. Wydaje się, że rozwiązanie to idealne rozwiązanie.
Muszę jednak zaznaczyć, że berberyna na ten moment jest suplementem, a nie lekiem i nie każda dostępna na rynku będzie równie skuteczna. Zwróć uwagę, by preparat był standaryzowany na zawartość substancji aktywnej. Producent wówczas poda na opakowaniu informację (przykładowa) „ekstrakt z korzenia berberysu (99% siarczanu berberyny)”. I takich suplementów z berberyną szukaj.
Co jeszcze ważne, berberyna charakteryzuje się dość słabą wchłanialnością, dlatego zalecane jest połączenie jej z sylimaryną (pozyskiwaną z ostropestu plamistego) w celu zwiększenia biodostępności.
Dzienna dawka berberyny powinna wynosić między 200 a 1000 mg (maksymalna zalecana dzienna dawka nie powinna przekraczać 1500 mg/dzień). Powinno się przyjmować ją w trzech mniejszych dawkach do posiłku lub bezpośrednio po nim. Jednorazowe przyjęcie dużej dawki berberyny może spowodować dolegliwości gastryczne, tak jak w przypadku metforminy.
Nie należy także jednocześnie stosować metforminy i berberyny, gdyż berberyna może nasilać działanie tej pierwszej i wywoływać niebezpieczne działania niepożądane. Pomimo że berberynę kupisz bez recepty, to warto skonsultować się z lekarzem/farmaceutą, czy jest to dla Ciebie dobry wybór.
Probiotyki łagodzą skutki uboczne metforminy- sprawdź, jakie szczepy!
Gdy nie tolerujemy metforminy, nie zawsze rozwiązaniem jest wymiana jej na berberynę. Problemy żołądkowo jelitowe, tak często zgłaszane przez pacjentów mogą być zniwelowane przez włączenie odpowiednich probiotyków. Badania z ostatnich lat wskazują, że negatywne efekty stosowania metforminy są związane stricte z mikrobiotą jelitową. Z tego powodu badacze postanowili sprawdzić czy przyjmowanie metforminy razem z probiotykiem wieloszczepowym może pomóc zmniejszyć dolegliwości żołądkowo-jelitowe u osób, które nie tolerują leku.
Grupa zakwalifikowanych uczestników badania (osoby, które nietolerowały metforminy) naprzemiennie stosowała probiotyki lub placebo. Pierwsza grupa przez 12 tygodni brała probiotyki, a potem przez kolejne 12 tygodni placebo; druga grupa robiła to w odwrotnej kolejności. Między pierwszą a drugą częścią badania była 4-tygodniowa przerwa, podczas której uczestnicy nie przyjmowali badanych leków i nie zmieniali swojego stylu życia. Całe badanie trwało 32 tygodnie.
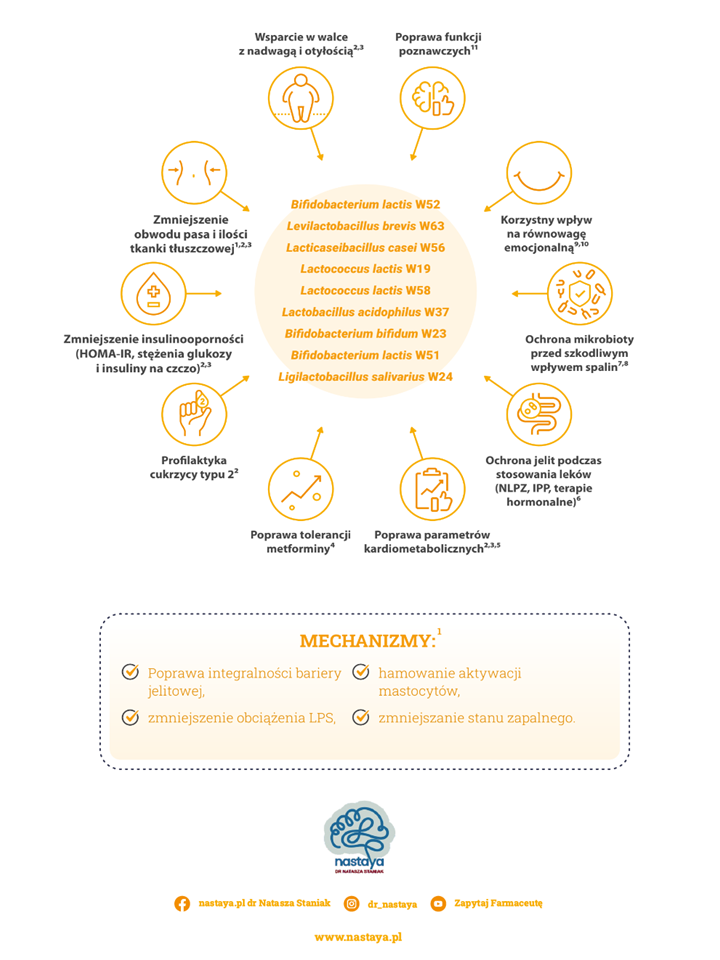
Zastosowany w badaniu probiotyk wieloszczepowy zawierał następujące szczepy: Bifidobacterium lactis W52, Levilactobacillus brevis W63, Lacticaseibacillus casei W56, Lactococcus lactis W19, Lactococcus lactis W58, Lactobacillus acidophilus W37, Bifidobacterium bifidum W23, Bifidobacterium lactis W51, Ligilactobacillus salivarius W24), dostępny na rynku jako Sanprobi Barrier. Uczestnicy przyjmowali 2 kapsułki rano i 2 kapsułki wieczorem, co odpowiadało dawce dobowej 2 × 10⁹ CFU.
Do oceny skutków metforminy zastosowano kwestionariusz dotyczący objawów żołądkowo-jelitowych (MSSS, Metformin Symptom Severity Score). Dzięki niemu można było określić, jaką największą dawkę metforminy pacjenci są w stanie tolerować i jakie dokładnie mieli dolegliwości.
Jakie efekty przyniosła probiotykoterapia?
Stosowanie probiotyków łącznie z metforminą istotnie zmniejszyło częstość występowania, ilość i nasilenie nudności, częstość i nasilenie wzdęć/bólu brzucha, a także spowodowało znaczną poprawę tolerancji metforminy. Jeżeli jesteś w grupie osób, które źle tolerują metforminę, to powinieneś rozważyć włączenie KONKRETNEJ probiotykoterapii, bo pamiętaj, że działanie probiotyków jest szczepozależne i w tym przypadku zastosowanie wybranego preparatu przyniosło zamierzone efekty. Inne szczepy mogą tak nie zadziałać.
Inozytol – kto powinien wziąć pod uwagę suplementację?
Obok berberyny, inozytol jest kolejną propozycją wsparcia leczenia insulinooporności. W odróżnieniu od berberyny, może być łączony z metforminą, ale zawsze warto skonsultować to ze swoim lekarzem diabetologiem lub farmaceutą.
Co to właściwie jest inozytol? Inozytol jest substancją podobną w budowie do witamin, z tego względu czasem nazywany jest witaminą B8. Bogatymi źródłami inozytolu są świeże warzywa i owoce, zwłaszcza fasola, groszek oraz owoce cytrusowe. Poza tym syntetyzowany jest w naszym organizmie, ale są sytuacje, kiedy warto zainteresować się jego suplementacją. I tak jest właśnie w przypadku insulinooporności, choć nie tylko. Korzyści odniesie osoba z PCOS (faktem, że u tych kobiet IO występuje bardzo często), ale także osoby z chorobą Hashimoto, choć o tym, kiedy indziej.
Inozytol ma kilka form, a najpopularniejsze i wykorzystywane w suplementacji są mio-inozytol (MYO) i d-chiro-inozytol (DCI). Badania kliniczne na kobietach z PCOS i insulinoopornością dowodzą, że włączenie do terapii inozytolu niesie wiele korzyści, nie tylko w kontekście gospodarki węglowodanowej.
W jednym z nich zbadano skuteczność 8-tygodniowej suplementacji mio-inozytolem (2g/dzień) u otyłych kobiet z PCOS, insulinoopornością i zaburzeniami hormonalnymi. Po zakończeniu terapii mio-inozytolem zaobserwowano w grupie kobiet obniżenie wskaźnika masy ciała (BMI), HOMA-IR, spadkowi uległ także hormon luteinizujący (LH), stosunek LH/FSH i insulina. Lepsze efekty zaobserwowano u kobiet, które na starcie miały insulinę na czczo powyżej 12 µU/ml. U nich po 8-tygodniowej suplementacji insulina z 20,3 µU/ml spadła do nawet 12,9 µU/ml!
Analizując liczne publikacje naukowe, dochodzimy do wniosku, że najlepsze efekty daje podawanie mio-inozytolu i d-chiro-inozytolu w takiej proporcji, w jakiej występuje naturalnie we krwi, tj. 40:1. Takich też preparatów powinniśmy szukać. Terapeutyczna dawka dobowa to 2-4 g inozytoli (sumarycznie dwóch form). Osobiście, ja zdecydowanie częściej proponuję włączenie u pacjentów z insulinoopornością inozytolu niż berberyny, ale jest to kwestia indywidualna.
Znaczenie mikrobioty jelitowej w insulinooporności
Dbałość o mikrośrodowisko jelitowe to nieodłączny element leczenia wielu schorzeń, w tym zaburzeń metabolicznych. Dlaczego? Bo od jelit wiele się zaczyna! Mikrobiota każdego z nas pełni masę funkcji, z których my czerpiemy. Wspomaga trawienie, współpracuje z układem hormonalnym, immunologicznym, wpływa na zdrowie wątroby, stan naszej skóry, a nawet zdrowie psychiczne. Generalnie dba o porządek i homeostazę w organizmie. Dlatego też zmiany w mikrobiocie jelitowej odbijają się na naszym zdrowiu, także metabolicznym.
Kiedyś już o tym pisałam, ale przypomnę. Mikrobiota w stanie nierównowagi (dysbiozy) może promować zwiększony pobór energii ze spożywanych pokarmów. Wówczas wzrasta masa ciała, a jak tyjemy, to zmniejsza się naturalnie insulinowrażliwość. Poza tym nasza mikrobiota może wpływać na apetyt i niejako dokonywać za nas (niezdrowych) wyborów żywieniowych. Ma ona również swój udział w spowalnianiu pasażu jelitowego, a to wydłuża czas wchłaniania związków odżywczych i pozyskiwania z nich energii. I co bardzo ważne, dysbioza ingeruje w selektywność bariery jelitowej (dochodzi do rozszczelnienia jej), co jest trigerem stanu zapalnego i idzie z parze z insulinoopornością.
Nie wiemy dokładnie, od czego insulinooporność się zaczyna, co jest czynnikiem wyzwalającym u konkretnego pacjenta, ale niewątpliwie mikrobiota ma w jej powstawaniu swój udział, a idąc dalej, na skutek zaburzonej gospodarki węglowodanowej, niekorzystnie się zmienia. A to może dolewać „oliwy do ognia”, utrudniać spadek masy ciała i regulację wyników badań. To dlatego, ja właściwie zawsze w suplementacji rozpisuję pacjentom z insulinoopornością, hiperinsulinemią czy podwyższoną glikemią choć 3-miesięczną probiotykoterapię dobrym, wieloszczepowym preparatem.
Zależy mi na „naprawie” bariery jelitowej, uszczelnieniu jej, co zniweluje przechodzenie do krwi prozapalnych składników np. lipopolisacharydu LPS, ale także odciąży ją czasowo, aby mogła na spokojnie zregenerować się i później już sama spełniać swoje funkcje. Wiesz, dlaczego to takie ważne? Przeciekająca bariera jelitowa sprzyja endotoksemii, czyli mówiąc prościej, takiemu wewnętrznemu zatruciu. Wiąże się z przewlekłym stanem zapalnym, bo wraz z krwią LPS dopływa właściwie wszędzie. Ta endotoksemia sprzyja również wzrostowi tkanki tłuszczowej a ona ciągnie za sobą kaskadę kolejnych zdarzeń, nasila ci insulinooporność, ale też zwiększa ryzyko chorób sercowo-naczyniowych i problemów hormonalnych. Trzeba z tego wyjść i zastosować celowaną probiotykoterapię.
Probiotyki w insulinooporności. Jakie szczepy wybrać?
Celem probiotykoterapii jest uszczelnianie bariery jelitowej, przywrócenie eubiozy mikrobioty i tym samym zmniejszanie stanu zapalnego, a poprzez to zmniejszenie insulinooporności. Tego oczekujemy od probiotyku w przypadku omawianego dziś zaburzenia metabolicznego.
Niestety nie każdy probiotyk będzie sprzyjał redukcji insulinooporności, ponieważ działanie probiotyków jest szczepozależne. Dany szczep czy zestaw szczepów musi mieć udokumentowane działanie kliniczne w danym problemie zdrowotnym. Wówczas z czystym sumieniem możemy go polecić np. osobie z insulinoopornością. Na szczęście mamy na rynku preparaty, które takie działanie wykazują.
Po pierwsze, preparat dziewięcioszczepowy (Bifidobacterium lactis W52, Levilactobacillus brevis W63, Lacticaseibacillus casei W56, Lactococcus lactis W19, Lactococcus lactis W58, Lactobacillus acidophilus W37, Bifidobacterium bifidum W23, Bifidobacterium lactis W51, Ligilactobacillus salivarius W24), dostępny na rynku jako Sanprobi Barrier.
W 2018 roku opublikowano wyniki badań klinicznych w grupie 81 kobiet w wieku około- i pomenopauzalnym, które przyjmowały wspomniany preparat. Badane z racji specyficznego okresu fizjologicznego (obniżona produkcja estrogenów) miały otyłość, a przy tym zwiększone ryzyko chorób metabolicznych (w tym insulinooporności) i kardiologicznych.
Badane suplementowały przez 12 tygodni Sanprobi Barrier. Przed rozpoczęciem kuracji i po jej zakończeniu poddano je pomiarom antropometrycznym i wykonano ocenę wybranych parametrów z krwi.
Jakie korzyści odnotowano po 12 tygodniach przyjmowania probiotyku?
- spadek poziomu lipopolisacharydu LPS (czyli obniżenie ogólnego stanu zapalnego),
- zmniejszenie obwodu pasa i ilości tkanki tłuszczowej,
- zmniejszenie stężenie cholesterolu całkowitego i LDL we krwi,
- zmniejszenie stężenia glukozy, insuliny oraz wskaźnika HOMA-IR,
- redukcję kwasu moczowego w surowicy krwi.
Po drugie dla kobiet z insulinoopornością, a także z PCOS, mogę wskazać preparat (synbiotyk) siedmioszczepowy (Bifidobacterium lactis W51, Lactobacillus acidophilus W22, Lactiplantibacillus plantarum W21, Lactococcus lactis W19, Bifidobacterium lactis W52, Lacticaseibacillus paracasei W20, Ligilactobacillus salivarius W24) z prebiotykami (FOS i inulina).
W 2021 roku opublikowano wyniki badań klinicznych na grupie 65 kobiet z rozpoznanym PCOS i nadwagą lub otyłością, które poddano diecie redukcyjnej, połączonej z 30-40-minutowym codziennym spacerem. Uczestniczki badania podzielono na dwie grupy, gdzie pierwsza grupa otrzymywała synbiotyk (SANPROBI Super Formula), a druga placebo. Korzyści odniosły obie grupy kobiet, jednak te z włączoną suplementacją synbiotyczną miały istotnie lepsze efekty. Mowa o kilku aspektach – niższy wskaźnik BMI, znaczna redukcja obwodu tali, bioder i ud oraz zawartości tkanki tłuszczowej. Niewątpliwie ogromną korzyścią u kobiet z nadwagą i otyłością, chorujących na PCOS jest redukcja masy ciała. Poprawia ona insulinowrażliwość i tym samym reguluje resztę hormonów zaangażowanych w chorobę. Nie zawsze sama dieta i aktywność fizyczna są w pełni skuteczne.
Po trzecie, postbiotyk Akkermansia muciniphila. Niewątpliwie widać jej miejsce w zaburzeniach metabolicznych, w których mamy „defekt” funkcjonalności bariery jelitowej. Z publikacji naukowych wiemy, że Akkermansia uszczelnia barierę jelitową. Z jednej strony „pilnuje” jej poprzez manewrowanie grubością warstwy śluzowej, z drugiej zwiększa produkcję białek połączeń ścisłych pomiędzy komórkami nabłonka jelit. Poza tym AM redukuje lokalny stan zapalny zlokalizowany w jelitach i obniża stężenie lipopolisacharydu bakteryjnego (LPS) w wątrobie i mięśniach. To bardzo cenne funkcjonalności tej bakterii, gdyż coraz bardziej powszechne choroby metaboliczne związane z otyłością idą w parze ze zwiększoną przepuszczalnością jelit, endotoksemią metaboliczną i stanem zapalnym.
Badania przedkliniczne pokazują, że suplementacja AM obniża poziom glukozy we krwi na czczo u gryzoni karmionych dietą typu „western-style”. A seria kolejnych badań na zwierzętach wykazała, że suplementacja AM może regulować również metabolizm lipoprotein gospodarza, poprawić wrażliwość na insulinę i łagodzić zapalenie wątroby u myszy.
Akkermansia muciniphila jest bakterią ściśle beztlenową, dlatego nie suplementujemy żywej bakterii a nieaktywną jej formę tzw. postbiotyk. Bez obaw, on okazuje się nawet bardziej skuteczny, niż żywa bakteria. Mam o Akkermansii osoby wpis na blogu, zachęcam Cię do przeczytania tutaj.
Witamina D, B12, magnez, omega-3. Dlaczego tak ważne w zaburzeniach gospodarki węglowodanowej?
Być może nie wszystkie wymienione w nagłówku składniki są Ci niezbędne w tym momencie, ale jak mam przed sobą pacjenta z insulinoopornością i otyłością, to one pierwsze przychodzą mi na myśl. Już tłumaczę, dlaczego?
Witamina D
Bez względu na stan zdrowia, otyłość czy problemy metaboliczne, gdy proszę pacjenta o oznaczenie witaminy D3, to u większości osób wykrywam niedobór i to znaczny. Dziwi mnie to, bo wydaje się, że o witaminie D mówi każdy lekarz, farmaceuta i wiedza na temat potrzeby suplementacji jest spora. Nie idzie to jednak w parze z praktyką. A szkoda. Witamina D ma bardzo szerokie działanie, pomaga we wchłanianiu wapnia, przez co korzystnie wpływa na układ kostny, ma swój udział w regulacji ciśnienia tętniczego krwi, a nawet w regulacji masy ciała.
Nawiązując do insulinooporności, niektóre doniesienia naukowe mówią o tym, że niedostateczna podaż witaminy D3 może brać udział w powstawaniu insulinooporności. Stąd ważne jest, abyś miał/miała witaminę D w swojej apteczce. Przed rozpoczęciem suplementacji najlepiej wykonać badanie 25(OH)D3 i na jego podstawie ustalić indywidualną dawkę. Za optymalny poziom witaminy D w organizmie uznaje się 30-50 ng/ml. Po podjęciu suplementacji, warto badanie powtarzać co kilka miesięcy, aby w razie potrzeb elastycznie zmieniać dawkowanie.
Witamina B12 (kobalamina)
Czy wiesz, że anemia nie wynika wyłącznie z niedoboru żelaza? Anemia makrocytarna (z niedoboru B12/kwasu foliowego), daje podobne objawy, co ta z niedoboru żelaza (mikrocytarna) i wcale nie występuje tak rzadko, jakby się wydawało. Rutynowo zazwyczaj nie oznaczamy we krwi witaminy B12 i kwasu foliowego, ale przeglądając ogólną morfologię krwi moich podopiecznych, zwracam uwagę na parametr MCV, czyli średnią objętość krwinki czerwonej. Jeżeli dodatkowo pacjent skarży się na zmęczenie, osłabienie, a MCV jest wysokie, to mamy trop. Może to być niedobór witaminy B12 i/lub kwasu foliowego, dlatego potrzebna jest szczegółowa diagnostyka.
Mitem jest, że niedobór B12 jest rzadki i jak już to dotyczy osób będących na diecie wegańskiej. U nich faktycznie ryzyko niedoboru jest większe, gdyż kobalamina naturalnie występuje wyłącznie w produktach odzwierzęcych, ale ja w gabinecie wegan mam bardzo mało, a jednak „wykrywam” anemię z niedoboru B12. Dlaczego? Być może, dlatego, że mam bardzo dużo podopiecznych na metforminie i po nitce do kłębka docieramy do sedna sprawy.
Leczenie „pierwszego rzutu” insulinooporności, czyli metformina, przyczynia się do większego ryzyka niedoboru B12, a potencjalnych mechanizmów jest kilka.
Jednym z nich jest stymulacja przerostu bakteryjnego jelita cienkiego, powodującego zaburzenia trawienia i wchłaniania, które w konsekwencji prowadzą do niedoboru witaminy B12. Metformina może prowadzić także do hamowania lub inaktywacji absorbcji witaminy B12 poprzez zmniejszenie ilości Czynnika Castle’a (jest to białko wytwarzane przez komórki okładzinowe żołądka, które łączy się z witaminą B12 i ułatwia jej wchłanianie). Dodatkowo ryzyko wystąpienie niedoboru witaminy B12 wzrasta wraz z wiekiem, dobową dawką metforminy i czasem jej stosowania.
Wróćmy do objawów i ryzyka niedoboru B12, początkowo są one podobne do deficytu żelaza, ale wraz z pogłębiającym się niedoborem dochodzą zaburzenia neurologiczne, demencja i zaburzenia psychiczne. Poza tym, niedobór B12 zwiększa ryzyko chorób układu krążenia, gdyż prowadzi do nadmiaru homocysteiny. Ta ostatnia (w nadmiarze) toksycznie wpływa na komórki i naczynia krwionośne. Zatem sprawa jest poważna. Dlatego tak ważne jest oznaczanie witaminy B12 u osób będących na metforminie! Muszę tu także zaznaczyć, że suplementacja B12 bez kontroli i zastanowienia, „biorę metforminę, muszę suplementować B12”, jest niewłaściwym rozwiązaniem. Nie każdy rozpoczynający kurację metforminą będzie potrzebował B12.
Magnez
Z punktu widzenia zaburzeń gospodarki węglowodanowej, magnez to bardzo ważny składnik mineralny, ponieważ bierze udział w wydzielaniu insuliny przez trzustkę oraz transport glukozy do komórek. Niedoborowa dieta, uboga w magnez, może pośrednio przyczynić się do insulinooporności. Naukowcy obserwują, że u pacjentów z cukrzycą typu 2 częstsze są niedobory magnezu niż w populacji ogólnej. Pierwiastek ten jest ważnym kofaktorem wielu reakcji enzymatycznych. A jego deficyt idzie w parze u pacjentów z cukrzycą typu 2, z narastającą insulinoopornością i związaną z tym zmniejszoną utylizacją glukozy. To też nasila stres oksydacyjny, co pociąga za sobą kolejne konsekwencje zdrowotne, jak np. choroby układu sercowo-naczyniowego czy nowotwory. Niewątpliwie o podaż magnezu wraz z dietą dbać trzeba. Najwięcej tego pierwiastka dostarczysz wraz z kaszą gryczaną, komosą ryżową, pestkami dyni, zielonymi warzywami liściastymi, nasionami (siemieniem lnianym, nasionami chia, sezamem, makiem) i białą fasolą.
Kiedy sięgnąć po suplementację magnezem? Wbrew pozorom nie jest to takie proste jak w przypadku witaminy D czy B12, gdyż nie dysponujemy testami laboratoryjnymi o wysokiej czułości i swoistości, które pozwoliłyby na dokładną ocenę kliniczną poziomu magnezu. Możesz oznaczyć magnez we krwi, ale każdy dobry specjalista powie ci, że prawidłowa wartość nie oznacza, że wszystko jest ok. Rzeczywisty niedobór magnezu może przebiegać bez obniżenia tego pierwiastka w osoczu. Natomiast, gdy hipomagnezemia będzie widoczna w wynikach krwi, to oznacza, że mamy już znaczący ogólnoustrojowy niedobór magnezu. Warto byłoby tę sytuację uprzedzić, dlatego specjalista, analizując twoją sytuację, powinien zasugerować, czy jesteś w grupie ryzyka i czy w twoim przypadku suplementacja magnezem jest wskazana. Z mojego doświadczenia wynika, że jeżeli pacjent jest narażony na przewlekły stres, dużo pracuje umysłowo lub jest mega aktywny fizycznie, czy to w związku z pracą zawodową, czy hobbistycznie lub po prostu przyjmuje metforminę, to dodatkowego magnezu w suplementacji potrzebuje. Ja osobiście rekomenduje włączyć suplementację magnezem u swoich podopiecznych z insulinoopornością, początkowo nawet niedużymi dawkami na poziomie 100-200 mg/dobę. Ważne, aby wybierać dobrze przyswajalne formy jak cytrynian, jabłczan czy taurynian magnezu.
Kwasy tłuszczowe omega-3
Włączenie suplementacji „rybiej omegi” jest właściwie niezbędne we wszystkich chorobach zapalnych. A zaburzenia gospodarki węglowodanowej także zaliczają się do tej puli. Badania naukowe wskazują, że omega-3 (zwłaszcza EPA i DHA) poprawiają insulinowrażliwość komórek i zmniejszają ryzyko cukrzycy typu 2. Widać to wyraźnie w populacji Eskimosów zamieszkujących Alaskę i Grenlandię, którzy wraz z dietą dostarczają znacznych ilości kwasów omega-3 i tym samym rzadziej chorują na cukrzycę.
Przypuszcza się, że wzbogacenie diety w kwasy tłuszczowe omega -3 zwiększa wbudowywanie ich w błonę fosfolipidową komórek beta trzustki, zwiększając w ten sposób wydzielanie insuliny. Prawdopodobnie podobne zmiany zachodzą w składzie błon fosfolipidowych komórek obwodowych. Te zmiany w fosfolipidach błonowych teoretycznie zwiększają powinowactwo i czułość wiązania receptorów insuliny, zwiększając w ten sposób transport glukozy przez ich błony. Tym sposobem odpowiednia podaż omega-3 wraz z dietą lub suplementacją bardzo korzystnie wpływa na metabolizm węglowodanów i reguluję glikemię.
Udowodniono to w licznych badaniach. W jednym z badań interwencyjnych, przeprowadzonych na zdrowych starszych osobach wykazano, że spożycie tłustych ryb zamiast chudych znacząco poprawia insulinowrażliwość. Badani spożywali około 720 g tłustych ryb tygodniowo i 15 ml oleju z sardynek dziennie. Wyobraźcie sobie, że odpowiedź na insulinę w surowicy (czyli tzw. insulinowrażliwość) była o 62% wyższa po rybach i o 39% wyższa po posiłkach warzywnych w porównaniu z posiłkami z tłuszczami nasyconymi.
Pamiętajmy, że w badaniach podkreślana jest rola „morskich” omega-3. Jeżeli nie spożywamy regularnie (minimum 2 razy w tygodniu) tłustych ryb morskich (łososia, makreli, śledzia, sardynek, tuńczyka), warto rozważyć suplementację wysokiej jakości preparatami.
Według NCEŻ dobowe zapotrzebowanie na kwasy EPA+DHA dla osoby dorosłej wynosi 250 mg. W przypadku kobiet w ciąży i karmiących piersią oraz diabetyków zapotrzebowanie wzrasta do 600 mg/dobę, ja polecam nawet do 1,5-2 g. Ryzyko większej dawki jest żadne, a raczej możemy odnieść jeszcze więcej profitów dla zdrowia ogólnego. Szczególnie kobiety zgłaszają mi, że odkąd regularnie suplementują „omegę” to zauważyły, że ich cera wygląda lepiej a włosy mniej wypadają. Takie efekty uboczne mogą być dla większości do zaakceptowania ;)
Podsumowując, suplementacja konkretnymi składnikami może realnie wspomóc leczenie behawioralne i farmakologiczne, dlatego warto rozważyć włączenie omawianych składników. Pamiętaj jednak, że zawsze konsultuj swoje wybory z lekarzem, który zna twoją sytuację zdrowotną i leki, które przewlekle przyjmujesz, nie tylko te związane z insulinoopornością.
Pomimo dużego znaczenia witaminy D, magnezu, inozytoli, probiotykoterapii czy kwasów omega-3 w kontekście regulacji gospodarki węglowodanowej, sama suplementacja nie powstrzyma cukrzycy typu 2, która jest następstwem insulinooporności. Dlatego podejdź do diagnozy rozważnie, połącz wszystkie kropki, aby zintensyfikować działania i osiągnąć zamierzony cel. Trzymam za ciebie mocno kciuki.
Jeżeli uznasz, że cykl moich trzech wpisów o insulinooporności może się komuś przydać, to podeślij mu je. Jest to dla mnie ważne, że teksty, które tworzę, pomagają innym. Dziękuję.
- Insulinooporność. O co w niej chodzi? https://zkaloriami.pl/insulinoopornosc-diagnostyka-i-zrozumienie-problemu/
- Insulinooporność. Jak odżywiać się, aby powstrzymać cukrzycę? https://zkaloriami.pl/insulinoopornosc-jak-odzywiac-sie-aby-powstrzymac-cukrzyce-typu-2/
ARTYKUŁ POWSTAŁ WE WSPÓŁPRACY Z MARKĄ SANPROBI
Bibliografia:
- Li Z, Geng YN, Jiang JD, Kong WJ. Antioxidant and anti-inflammatory activities of berberine in the treatment of diabetes mellitus. EvidBasedComplementAlternat Med. 2014
- Dong, Hui et al. “Berberine in the Treatment of Type 2 Diabetes Mellitus: A Systemic Review and Meta-Analysis.” Evidence-based Complementary and Alternative Medicine : eCAM 2012 (2012)
- Lan J, Zhao Y, Dong F, Yan Z, Zheng W, Fan J, Sun G. Meta-analysis of the effect and safety of berberine in the treatment of type 2 diabetes mellitus, hyperlipemia and hypertension. J Ethnopharmacol. 2015 Feb 23;161:69-81
- Szymczak-Pajor I., Drzewoski J., Śliwińska A. (2020): The Molecular Mechanisms by Which Vitamin D Prevents Insulin Resistance and Associated Disorders. International Journal of Molecular Sciences. 21(18): 6644.
- Pramono A, Jocken JWE, Blaak EE. Vitamin D deficiency in the aetiology of obesity-related insulin resistance. Diabetes Metab Res Rev. 2019 Jul;35(5):e3146. doi: 10.1002/dmrr.3146. Epub 2019 Mar 18. PMID: 30801902.
- Lardinois CK. The role of omega 3 fatty acids on insulin secretion and insulin sensitivity. Med Hypotheses. 1987 Nov;24(3):243-8. doi: 10.1016/0306-9877(87)90071-5. PMID: 3320694.
- Tsitouras PD, Gucciardo F, Salbe AD, Heward C, Harman SM. High omega-3 fat intake improves insulin sensitivity and reduces CRP and IL6, but does not affect other endocrine axes in healthy older adults. Horm Metab Res. 2008 Mar;40(3):199-205. doi: 10.1055/s-2008-1046759. PMID: 18348080.
- Genazzani AD, Prati A, Santagni S, Ricchieri F, Chierchia E, Rattighieri E, Campedelli A, Simoncini T, Artini PG. Differential insulin response to myo-inositol administration in obese polycystic ovary syndrome patients. Gynecol Endocrinol. 2012 Dec;28(12):969-73. doi: 10.3109/09513590.2012.685205. Epub 2012 May 21. PMID: 22612517.
- Efekty przyjmowania synbiotyku i modyfikacji stylu życia u kobiet z zespołem policystycznych jajników, The Journal of Clinical Endocrinology & Metabolism, 2021
- Szulińska i wps.., Dose-Dependent Effects of Multispecies Probiotic Supplementation on the Lipopolysaccharide (LPS) Level and Cardiometabolic Profile in Obese Postmenopausal Women: A 12-Week Randomized Clinical Trial, „Nutrients” 2018, 10